کلونینگ ( Cloning )
ژن کلونينگ فرآيندي است که طي آن توالي مشخصي از DNA را جداسازي ميکنند تا نسخههاي يکساني از آن را در محيط طبيعي ( سلول يا بافت زنده ) بدست آورند.هدف از ژن کلونينگ فراهم کردن نسخههاي متعدد از يک ژن منفرد است. تکثير يک ژن در حوزههاي مختلف تحقيقاتي مورد استفاده است. به علاوه داراي کاربردهاي پزشکي از قبيل ژن درماني و کاربردهاي صنعتي نظير توليد مقدار زيادي از يک پروتئين ميباشد.براي کلون کردن ژن قطعهاي از DNA را از موجودي به موجود ديگر منتقل ميکنند. سلولي را که منشا DNA از آن است را « دهنده » و سلولي را که آن را دريافت ميکند « ميزبان» ميگويند.
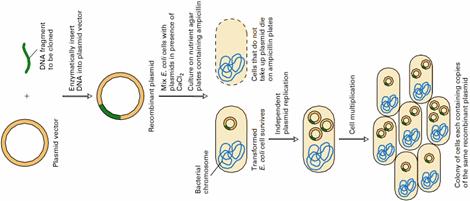
تکثير ژن
کلونينگ ژن به روشهاي مختلفي صورت
ميگيرد اما اساس همهي آنها به اين صورت است که DNA هدف از سلول دهنده
استخراج ميشود و با کمک آنزيمهايي برش داده ميشود و به داخل يک مولکول
DNA حلقوي، که معمولاً يک پلاسميد است و نقش ناقل ( وکتور ) را دارد، وارد
ميشود. به اين ترتيب يک مولکول DNA نوترکيب ساخته ميشود. در مرحلهي بعد
DNA نوترکيب را به سلول ميزبان که اغلب نوعي باکتري ميباشد منتقل
ميکنند. اين مرحله را ترنسفورماسيون مينامند. DNA نوترکيب در سلول
ميزبان همانندسازي ميکند و همراه سلول ميزبان تکثير ميشود. سلولهاي حاصل
از تقسيم سلول ميزبان اوليه، نسخههايي از DNA نوترکيب همانندسازي شده را
به ارث ميبرند. سلولهاي باکتري به دنبال تقسيمات متعدد کلني تشکيل
ميدهند و از آنجا که اعضاي اين کلوني حاوي يک يا چند نسخه از ژن مورد نظر
ما که در DNA نوترکيب حمل ميشود ميباشد، ميتوان گفت اين ژن کلون شده
است.
استخراج و برش ـ اولين گام در توليد DNA نوترکيب و سپس کلون کردن
آن، استخراج و برش وکتور از سلول باکتري و DNA از سلول دهنده ميباشد.
براي
استخراج DNA از سلول دهنده، ابتدا بايد «عصارهي سلولي» تهيه کرد. براي
اين منظور غشاي سلول را متلاشي ميکنند تا محتويات آن خارج شود سپس مخلوط
حاصل را سانتريفيوژ ميکنند تا زوائد آن تهنشين شود و مايع رويي که
«عصارهي سلولي» است و حاوي DNA ميباشد را جمع آوري ميکنند. عصارهي
سلولي علاوه بر DNA حاوي پروتئين و RNA نيز ميباشد. با يکي از روشهاي
«تجزيهي آنزيمي پروتئين و RNA » يا «کروماتوگرافي تعويض يوني» DNA را از
عصارهي سلولي تخليص ميکنند. براي استخراج پلاسميد از سلول باکتري، بعد از
تخليص DNA بايد پلاسميد را از DNA کرومزوم باکتري جدا کرد. براي اين منظور
از تکنيک « اولتراسانتريفيوژ » که بر مبناي شيب جرمي ميباشد استفاده
ميکنند.
بعد از جداسازي، DNA سلول دهنده بايد به قطعات کوچکتر بريده
شود. برش DNA به قطعات کوچکتر را ميتوان از طرق راههاي مختلفي انجام داد
از آن جمله ايجاد شکست در DNA با استفادها از امواج صوتي ( سونيکيت
)ميباشد. در اين صورت طول قطعات حاصل از يک مولکول DNA با مولکول ديگر
متفاوت خواهد بود چرا که شکست مولکول DNA به صورت تصادفي صورت ميگيرد. کشف
«آنزيمهاي محدود کننده» (restriction enzymes) محققان را قادر ساخت
تابتوانند قطعات با طول يکسان را از چندين مولکول DNA يکسان فراهم کنند.
آنزيمهاي محدود کننده باکتريها را قادر به دفاع در مقابل فاژها ميکند.
اين آنزيمها مولکول DNA را درمحلهاي ويژهاي باترتيب نوکلوتيدي خاصي قطع
ميکنند. بنابراين براي آنکه يک مولکول DNA با اين آنزيمها بريده شود،
وجود تواليهاي خاصي به نام «جايگاه محدود کننده» در مولکول DNA ضروري است و
بايد براي برش DNA به دنبال آنزيمي گشت که داراي بيش از 2 جايگاه محدود
کننده بر روي آن باشد.همچنين مزيت ديگر استفاده از آنزيمهاي محدود کننده
اين است که ميتوان از همان آنزيم براي برش پلاسميد ناقل استفاده کرد و به
اين طرق امکان انطباق دو انتهاي قطعهي ژن هدف با دو انتهاي بريده شدهي
پلاسميد را به سادگي فراهم کرد.
انطباق دو انتهاي قطعهي ژن هدف با دو انتهاي بريده شدهي پلاسميد
برای اتصال دو DNA به یکدیگر در آزمایشگاه
از آنزیم DNA ligase استفاده میشود DNA ligase آنزیمی است که بین دو
نوکلئوتید اتصال فسفودی استر ایجاد میکند. دو نوع DNA ligase وجود دارد یکی
T4 DNA ligase که از فاژ T4 استخراج میشود وانرژی لازم برای فعالیت خود را
از ATP تامین میکند این آنزیم دوانتهای blunt وهمچنین دوانتهای Cohesive
را بهم متصل کند( اتصال فسفودی استر ایجاد میکند). دیگری DNA ligase باکتری
E.coli که انرژی لازم برای فعالیت خودراازNAD بدست می آورد و بیشتر برای
اتصال انتهاهای Cohesive استفاده میشود.
عمل Ligation طی سه مرحله انجام میگیرد :
در مرحله اول گروه آدنیلیل از ATP )
NAD ) به آنزیم متصل میشود و زنجیره جانبی NH2 اسید آمینه لیزین آدنیله
میشودو پیرو فسفات (با آنزیم T4 DNA ligase ) یا نیکو تینامید (با آنزیم
E.coli DNA ligase ) آزاد میشود.
در مرحله دوم گروه آدنیلیل به
انتهای 5`-P متصل میشود . در مرحله سوم اتصال فسفو دی استر بین گروه
هیدروکسیل 3`- OH و گروه فسفوریل آدنیله شده 5` برقرار میشودوAMP آزاد
میگردد.
انجام واکنش Ligation:
1- مقدار insert و vector را تخمین برنید ( برای انجام واکنش مولاریته insert را سه برابر vector در نظر بگیرید )
2- حجم واکنش را در نظر بگیرید ( بهتر است یک میکروگرم DNA را درواکنشی به حجم 20-30 میکرولیتر انجام گیرد )
3- با آب دوبار تقطیر استریل حجم واکنش را تنظیم کنید
4- واکنش را مدت 5 دقیقه در 45 درجه قرار دهیدتا انتهاهای Cohesive کاملا” Relax شوند
5- بافر Ligation را با غلظت نهایی 1x استفاده کنید
6- یک میکرولیتر آنزیم T4 DNA ligase به واکنش اضافه کنید
7- چند ثانیه آن را spin کنید
8- مدت 3-2 ساعت در دمای 37 درجه قرار دهیدو سپس واکنش را ترانسفرم کنید.
پیدا کردن کلنی های حاوی Recombinant DNA:
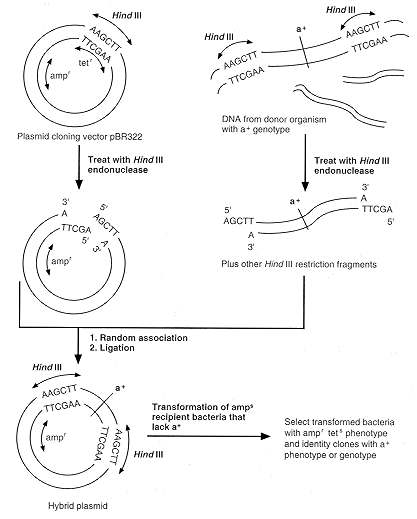
الف ) غیر فعال کردن ژن مقاومت به تتراسیکلین پلاسمید pBR322
جایگاه آنزیم BamHI روی سکانس ژن مقاومت
به تتراسیکلین پلاسمید pBR322 قرار دارد چنانچه DNA خارجی در جایگاه این
آنزیم کلون شود و پلاسمید نو ترکیب در باکتری ترانسفرم گردد ، باکتری نسبت
به تتراسیکلین حساس میشود.Insert DNA مورد استفاده که قطعه ای از DNA
میتوکندری (kDNA) انگل لیشمانیا میباشد در حدود 800bp است که آن را در
جایگاه BamHI پلاسمید pBR322 کلون میکنیم
1- محصول Ligation را درباکتری
HB101 ترانسفرم کنید ( باکتری XL1-blue نسبت به تتراسیکلین مقاوم است و
برای این آزمایش قابل استفاده نمیباشد).
2- محصول ترانسفرم شده را روی پلیت آگار حاوی آمپی سیلین و بدون تتراسیکلین پخش کنید.
3-
روز بعد یک Master plate حاوی آمپی سیلین و بدون تتراسیکلین تهیه کنید و
آن را شطرنجی نموده و خانه های آن را شماره گذاری نمایید سپس کلنی های حاصل
از ترانسفرماسیون شب قبل را داخل خانه های شطرنجی (شماره دار) پلیت منتقل
کنید.
4- روز بعدنیز آگار پلیت مشابه روز قبل تهیه کنید که دارای دو
آنتی بیوتیک آمپلی سیلین و تتراسیکلین باشد (100μg /ml آمپی سیلین و
12.5μg/ml تتراسیکلین ) و هر کلنی را در خانه هم شماره آن روی پلیت حاوی
تتراسیکلین و آمپی سیلین کشت دهید
5- روز بعد هر کدام از کلنی ها که رشد
نکرد ه باشند حاکی از حساس بود ن آنها به تتراسیکلین میباشد (قطعه DNA
مورد نظردر پلاسمید کلون شده است).
6- کلنی باکتری که رشد نکرده را از روی Master plate شماره 1 ( بدون تتراسیکلین ) پیدا کرده و از آن کشت شبانه تهیه کنید
پلاسمید
آن را استخراج کرده و با آنزیم BamHI آن را برش دهید ، بعد از الکتروفورز
باید قطعه DNA کلون شده را روی ژل مشاهده کنید ( تقریبا” 800bp میباشد ) .
ب) غیر فعال کردن ژن LacZ` پلاسمید Bluescript و مشاهده کلنی ها ی آبی و سفید
( alfa- complementation test ) همانطور
که قبلا” گفته شد MCS پلاسمید Bluescript داخل ژن LacZ` تعبیه شده است .
سکانس این ژن قسمتی ازسکانس ژن آنزیم β-galactosidase است , این آنزیم
اثصالات بتا گالاکتوزیدی لاکتوز را تجزیه کرده و لاکتوز را به گلوکز و
گالاکتوز تبدیل میکند , همچنین ماده X-gal را که آنالوگ لاکتوز میباشد
تجزیه کرده و رنگ آبی تولید میکند. سلولی (باکتری) که آنزیم بتا
گالاکتوزیداز آن ناقص باشد یعنی ژن قطعه LacZ` را نداشته باشد چنانچه با
پلاسمیدی که سکانس ژن LacZ` داشته باشد ترانسفرم گردد آنزیم بتا
گالاکتوزیداز آن کامل میشود و میتواند لاکتوز یا X-galرا تجزیه کند.
چنانچهinsert DNA درMCS این پلاسمید کلون شود ژن مذکور غیر فعال شده و
باکتری نمیتواند بعد ترانسفرم شدن با پلاسمید X-gal را تجزیه کند در نتیجه
رنگ آبی تولید نمیشود و کلنی های بیرنگ تولید میشود.
A) در سیستم
alfa-complementation test. کروموزوم باکتری ژن lacZ ناقص دارد و قسمت N
ترمینال(alfa peptide) ژنβ-galactosidase راکد نمیکند و محصول ژن فاقداین
قسمت میباشد . ژن lacZ` پلاسمید در داخل باکتری قسمت alfa peptide را کد
میکند و ژن بتا گالاکنوزیداز فانکشنال تولید میشود که در حضور X- gal رنگ
کلنی های باکتری آبی میشود . (b یک قطعه DNA در پلاسمید کلون شده ,ژن lacZ`
ناقص شده است ونمیتواندX-gal راتجزیه کند در نتیجه کلنی های باکتری سفید
میگردند.
1- DNA را در جایگاه آنزیم BamHI یا EcoRI پلاسمید Bluescipt کلون ( Ligate ) کنید.
2-
واکنش Ligation را داخل باکتری XL1- blue ترانسفرم کنید ( ژنآنزیم
β-galactosidase این باکتری ناقص است و همراه ژن LacZ` پلاسمید Bluescript
کامل میشود اما ژن آنزیم بتا گالاکتوزیداز باکتری HB101 کامل است وبرای این
منظور قابل استفاده نمیباشد )
3- باکتری ترانسفرم شده را روی آگار پلیت
حاوی X-gal و IPTG پخش کنید ( IPTG یک ماده القاء کننده پروموتور ژن است و
موجب بیان آنزیم β-galactosidase میشود ) .
4- قبل از پخش کردن واکنش روی پلیت , به هرکدام مقدار 40 میکرولیتر از 20 mM X- gal و 4 میکرولیتر از 200 mg/ml IPTG اضافه کنید.
5- روز بعد ( 16-12 ساعت ) کلنی های آبی و سفید روی پلیت آگاررشد میکنند که کلنی های سفید حاوی Recombinsnt plasmid میباشند
توجه
: اگر پلیت حاوی X- gal و IPTG را چند ساعت در 4 درجه قرار دهید رنگ آبی
بخوبی ظاهر میشود. مرکز کلنی حاوی ژن بتا گالاکتوزیداز آبی کم رنگ و محیط
آن آبی پررنگ است. در مرکز کلنی های سفید نقطه آبی خیلی کم رنگ دیده میشود
ولی محیط آنها بیرنگ است.
کلنی های سفید راکشت دهید و پلاسمید
آنهارااستخراج کنید. پلاسمید را با آنزیم BamHI هضم کنید باید بعد از
الکتروفورز قطعه DNA کلون شده را روی ژل مشاهده کنید
